Un spectrophotomètre est un appareil de laboratoire qui permet de
mesurer l’intensité de la lumière transmise par une solution
transparente. Il permet de tracer des courbes d’analyses spectrales utilisées
pour étudier la composition de solutions, de déterminer la concentration
de solutions ou de suivre l’apparition d’une espèce chimique colorée
au cours du temps…
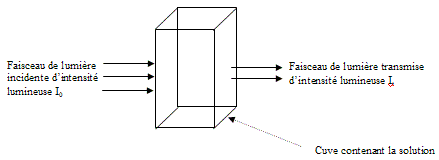
Pour mener ce TP, il vous suffit d’admettre que le spectrophotomètre
mesure l’intensité lumineuse du faisceau de lumière incidente
(I0) et celle du faisceau de lumière transmise (It) (voir schéma
ci-dessous). Le spectrophotomètre calcule alors l’absorbance A de la
solution : l’absorbance est un nombre sans unité qui dépend
du rapport et qui caractérise la solution.
Dans ce TP, vous allez étudier l’absorbance de solutions
de colorants alimentaires pour des lumières de différentes longueurs
d’onde et ainsi tracer les courbes d’analyse spectrale de ces solutions représentant
l’absorbance en fonction de la longueur d’onde. Pour tracer ces courbes, vous
utiliserez le tableur-grapheur Regressi.
Petite animation sur
le fonctionnement du spectrophotomètre 
A) Méthode
En superposant les spectres d'absorption de solutions titrées chaque
colorant, on constate qu 'au maximum de l'un, l'autre n'absorbe pas.
Superposer aux deux précédents, le spectre du sirop dilué:
la courbe d’absorption présente deux pics qui caractérisent
les colorants annoncés.
La loi de Beer-Lambert permet une proportion sur les absorbances aux pics
pour déterminer les concentrations en chaque colorant
B) Difficultés
Le spectrophotomètre peut s’échauffer et présenter
une dérive.
Le logiciel Spectro permet l’affichage des spectres superposés, mais
ne sauvegarde que le dernier obtenu: si on veut imprimer les spectres superposés,
il convient de les sauver l’un après l’autre dans des fichiers distincts
et de les réunir en sortant du logiciel Spectro, en lançant
le logiciel Regorphy et en utilisant la procédure Fichier- Ajoute
Travailler avec beaucoup de soin pour fabriquer les solutions et des cuves
en bon état.
C) Avantages
Rapidité d'obtention des spectres: grâce à une barette
CCD utilisée pour capter la lumière transmise, un spectre
complet, d’environ 2000 points sur la plage 400nm-700nm, est obtenu le seul
temps de cliquer!
D) Manipulation
Fabrication des solutions
-
solution de bleu patenté: à 1mg/L
-
solution de tartrazine: à 2mg/
-
sirop dilué: dilué 25 fois
Obtention des trois spectres superposés:
Relier le module spectro à Orphy en ref O.
Les mettre sous tension ,puis allumer l'écran et l'ordinateur.
Lancer CCDORPHY
Echap 2fois
Valider le menu Acquisition
Relever un spectre
spectre d'absorption
Cliquer sur l'icône zéro, placer l'écran noir, valider
Cliquer sur l'icône solvant, placer la cuve pleine d'eau, valider
Cliquer sur l'icône soluté, placer la cuve de solution titrée
de tartrazine, valider:
Cliquer à nouveau sur l'icône soluté, placer la cuve de
solution titrée de bleu patenté, valider, demander la super
position au spectre précédent
Cliquer encore sur soluté et recommencer avec le sirop dilué
-
Commenter les courbes
obtenues en précisant pour chacune d’elle.
-
Pour quelle(s) longueur(s)
d’onde l’absorbance est-elle importante et à quelle couleur correspondent
ces radiations.
-
Conclure sur la composition
de la solution de colorant vert.
