1. Manipulation
Comme
il est nécessaire de disposer de solutions de pH différents,
on utilisera une solution de départ dite de “ BRITTON-ROBINSON
” (notée BR) ; elle présente la propriété
de voir son pH augmenter par addition d’une solution d’hydroxyde
de sodium (soude) de concentration cb = 0,100 mol.L-1.
On peut admettre que le pH du mélange (BR + soude) obéit
à la relation numérique simple et approchée :
pH = 1,2 + v où v est le volume de soude ajouté, exprimé
en mL, pour un volume de solution BR de 20,0 mL.
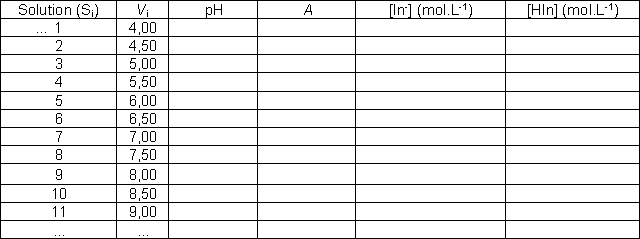
Pour disposer de solutions de pH s’échelonnant entre
3,5 et 11 par pas de 0,5 unité de pH environ, chacun des binômes
réalisera plusieurs solutions (BR + soude) notées Si.
Les résultats sont mis en commun et exploités par tous.
Toutes les mesures de pH sont effectuées avec le même
pH-mètre.
Préparation
de la solution (Si) :
-
prélever,
dans un premier becher, à l’aide de la pipette jaugée,
un volume V = 20,00 mL de solution Britton-Robinson ;
-
ajouter,
à la burette, le volume Vi de solution d’hydroxyde
de sodium de concentration molaire 1,00.10-1 mol.L-1
selon les indications figurant dans le tableau ci-dessous ;
-
prélever
10,00 mL de chacune des solutions ainsi préparées
dans un second becher, y ajouter 1,00 mL de solution de bleu de
bromothymol, soit (Si) la solution ainsi préparée.
-
Mesure
du pH de la solution (Si).
-
Mesure
de l'absorbance de la solution (Si) à l’aide d’un
spectrophotomètre unique :
-
régler
le spectrophotomètre à la longueur d’onde lamda
= 620 nm et faire le blanc ;
-
rincer
la cuve avec la solution (Si) et mesurer l’absorbance de la
solution (Si).
-
Consigner
les valeurs mesurées de l’absorbance et du pH dans
le tableau général.
2. Exploitation des résultats
- Afin de tracer la courbe
de l’évolution des concentrations des formes acide et
basique de l’indicateur, il faut établir, pour chacune
des deux formes de l’indicateur (basique d’une part, acide
d’autre part), une relation entre la concentration effective
de la forme considérée et l’absorbance mesurée.
a) En utilisant la
conservation de la quantité de matière effective,
écrire la relation entre la concentration molaire apportée
en bleu de bromothymol et les concentrations molaires effectives
des formes acide HIn et basique In-. Indication : Dans chaque
solution, la quantité de matière apportée
en bleu de bromothymol se retrouve en partie sous la forme acide
HIn et en partie sous la forme basique In-.
b) À la longueur
d’onde choisie, seule l’espèce In- absorbe
; en déduire la relation entre la concentration molaire
effective en In- et l’absorbance A à différents
pH.
c)
En considérant qu’à pH élevé
seule la forme basique du bleu de bromothymol, In-, est présente,
que vaut la concentration molaire effective en forme acide, Hin;
exprimer l’absorbance A, notée Amax, en fonction
de la concentration molaire apportée, c, en bleu de bromothymol.
d) Avec les trois
expressions trouvées précédemment, calculer
les valeurs des concentrations molaires effectives [HIn] et [In-].
- Construire sur le même
graphe les courbes représentatives de l’évolution
des valeurs des concentrations molaires effectives [In-] et [HIn]
en fonction du pH. En déduire les domaines de prédominance
des formes acide et basique de l'indicateur. Vérifier l’hypothèse
faite à l’absorbance maximale.
- Déterminer la
zone de virage de cet indicateur coloré, sachant que la zone
de virage d'un indicateur coloré est généralement
définie par l’intervalle de pH dans lequel le rapport
des concentrations molaires des formes acide et basique est tel que
:
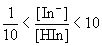 . .
- Montrer qu’un
point particulier de ce graphe permet de déterminer le pKA
du couple acide-base HIn/In- et donc sa constante d’acidité.
|
