2.Le produit ionique
de l’eau
En chimie , tout
état d'équilibre est défini à une
température donnée , par une constante d'équilibre
.
L'équilibre
relatif à la réaction d'autoprotolyse de l'eau
est défini par une constante sans dimension :
A 25°C Ke = [H3O+].[HO -
] = 10-14 Ke est appelé le
produit ionique de l'eau
Le produit ionique de l'eau est constant , dans toutes les solutions
aqueuses diluées .
• Remarque
: détermination de la [HO - ] connaissant la
valeur du pH:
Si d'une manière ou d'une autre , on modifie la concentration
en ions oxonium ou en ions hydroxyde , on déplace l'équilibre
de telle sorte qu'il n'y a plus égalité entre
les concentrations mais que le produit ionique Ke reste le même
.
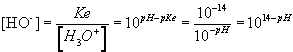
Exemple : [H3O+] = 1,0.10-3
mol.L-1 alors  à 25°C
à 25°C
3. Echelle de pH
Une solution est
neutre si elle contient autant d'ions oxonium H3O+
que d'ions hydroxyde HO - c'est à dire [H3O+]
= [HO - ]
d'où à 25° [H3O+].[HO -
] = [H3O+]² = Ke = 10-14
[H3O+] = [HO - ] = = 10-7 mol.L-1 pH = 7
= 10-7 mol.L-1 pH = 7
Dans une solution acide , la concentration en ions oxonium
H3O+ est supérieure à celle
en ions hydroxyde HO -
[H3O+] > [HO - ]
[H3O+] >  d'où [H3O+]² > Ke donc
[H3O+] >
d'où [H3O+]² > Ke donc
[H3O+] >  soit [H3O+] > 10-7 mol.L-1
ou pH < 7
soit [H3O+] > 10-7 mol.L-1
ou pH < 7
Dans une solution basique , la concentration en ions hydroxyde
est supérieure à celle en ions oxonium
[H3O+] < [HO - ]
[H3O+] <  d'où [H3O+]² < Ke [H3O+]
<
d'où [H3O+]² < Ke [H3O+]
< soit [H3O+] < 10-7 mol.L-1
pH > 7
soit [H3O+] < 10-7 mol.L-1
pH > 7

4. Introduction
à l’écriture de pKe
On définit
pKe = - log Ke
Remarque : Pour le corps humain pKe = 13,6
donc solution neutre pour pH = 1/2 pKe = 6,8

|
Ex
4/5/6 p.151 |
|
|