-
Transferts spontanés d’électrons
entre des espèces chimiques (mélangées ou séparées)
de deux couples oxydant/réducteur du type ion métallique/métal,
Mn+/M(s).
-
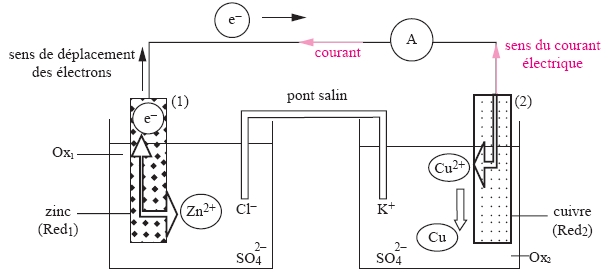
Constitution et fonctionnement d’une pile
: observation du sens de circulation du courant électrique,
mouvement des porteurs de charges, rôle du pont salin, réactions
aux électrodes. La pile, système hors équilibre
au cours de son fonctionnement en générateur. Lors
de l’évolution spontanée, la valeur du quotient
de réaction tend vers la constante d’équilibre.
La pile à l’équilibre “pile usée”
: quantité d’électricité maximale débitée
dans un circuit.
-
Force électromotrice d’une pile
(f.é.m.) E: mesure, polarité des électrodes,
sens de circulation du courant (en lien avec le cours de physique).
-
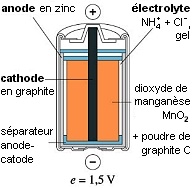
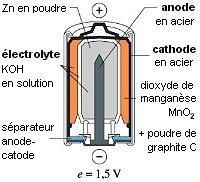
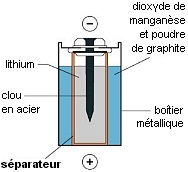
Exemple de pile usuelle.
|
- Schématiser une pile
-
Utiliser le critère d’évolution
spontanée pour déterminer le sens de déplacement
des porteurs de charges dans une pile.
-
Interpréter le fonctionnement d’une
pile en disposant d’une information parmi les suivantes :
sens de circulation du courant électrique, f.é.m.,
réactions aux électrodes, polarité des électrodes
ou mouvement des porteurs de charges.
-
Écrire les réactions aux électrodes
et relier les quantités de matière des espèces
formées ou consommées à l’intensité
du courant et à la durée de la transformation, dans
une pile et lors d’une électrolyse.
|