C. Le sens “spontané” d’évolution d’un système est-il prévisible?
Le sens d’évolution d’un système chimique peut-il être inversé ?
3. Exemples de transformations forcées (2H)
CONTENUS
|
COMPÉTENCES EXIGIBLES
|
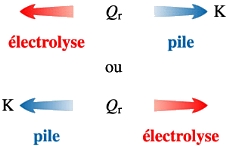
1. Transformation forcée
2. Aspect microscopique : Réaction aux électrodesLors d'une
électrolyse, comme dans le cas des piles, une réaction
est mise en jeu à chaque électrode. L'équation
de l'électrolyse est la somme des équations des réaction
aux électrodes.
L'électrode
à laquelle se produit l'oxydation est appelée anode
L'électrode à laquelle se produit la réduction est appelée cathode
3. Pile et accumulateur |