1. Données physico-chimiques
- Risques et sécurité
Anhydride acétique
:
Liquide incolore d’odeur piquante
Température d’ébullition (p = 1,013 bar) : 136,4
°C
Température de fusion (p = 1,013 bar) : - 73 °C
Soluble dans l’eau et l’éthanol
Densité : 1,082
Hydrolyse en présence d’humidité (bien refermer
le flacon).
Vapeurs irritantes pour les muqueuses oculaires et respiratoires.
En cas d’inhalation, faire respirer de l’air frais. En
cas de contact avec les yeux, laver abondamment à l’eau.
En cas d’ingestion faire boire beaucoup d’eau.
Produit inflammable. En cas d’incendie, extinction à
la poudre (n’utiliser ni eau, ni mousse carbonique).
Acide salicylique
:
Solide blanc
Température de fusion (p = 1,013 bar) : 159 °C
Peu soluble dans l’eau à froid, soluble à chaud,
très soluble dans l’alcool et l’éther.
Poudre irritante pour les muqueuses oculaires et respiratoires pouvant
provoquer des lésions oculaires. En cas d’inhalation,
faire respirer de l’air frais. En cas de contact avec les yeux
laver abondamment à l’eau, paupières écartées.
En cas d’ingestion faire boire beaucoup d’eau et provoquer
le vomissement.
Aspirine :
Solide blanc
Solubilité dans eau à 25 °C : 3,3 g.L-1
Décomposition à la chaleur (à partir de 128 °C,
p = 1,013 bar). Il est pour cette raison impossible de prendre un
point de fusion (compris entre 135 et 140 °C, p = 1,013 bar).
Très soluble dans l’éthanol.
2. Manipulation
Manipuler l’anhydride
acétique à côté des fenêtres ouvertes
avec des lunettes.
Synthèse
:
-
Utiliser de la verrerie bien sèche.
-
Utiliser l'agitateur magnétique chauffant et préparer un bain marie (entre 60 et 70°C, maintenir le bain-marie à cette température).
-
Réaliser le montage à reflux, introduire dans le ballon 5 g d'acide salicylique et le turbulent.
-
Ajouter 10 mL d'anhydride acétique et quelques gouttes d'acide sulfurique concentré.
-
Adapter un réfrigérant.
-
Chauffer au bain-marie pendant environ 20 minutes.
|
Pendant ce temps, préparer
la cuve à chromatographie et certains échantillons à
déposer.
Cristallisation
de l'acide acétylsalicylique :

|
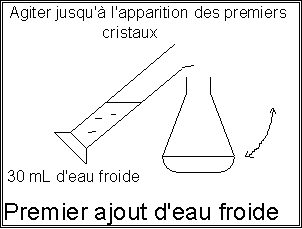
Retirer le bain-marie, maintenir l’agitation et la circulation d’eau dans le réfrigérant. Puis verser aussitôt, par petites quantités, par le sommet du réfrigérant environ 30 mL d’eau froide afin de détruire l’excès d’anhydride éthanoïque par hydrolyse.
Agiter doucement à la main l'erlenmeyer, jusqu'à cristallisation commençante. |
|
Ajouter alors 50 mL d'eau glacée et refroidir l'erlenmeyer dans la glace.
Maintenir dans la glace jusqu'à cristallisation complète. |

|
Filtrer le produit brut sur Büchner. Laver avec un peu d'eau froide. |
3. Exploitation
1. Déterminer la
quantité de matière des réactifs mis en jeu.
L’un d’entre eux est-il en excès ?
2. Calculer le rendement de la transformation. Mettre les résultats
en commun et comparer la réactivité de l’anhydride
acétique à celle de l’acide acétique. Conclure.
3. Quels sont les moyens mis en jeu pour augmenter la vitesse de réaction
?
4. Au vu de la réaction, pourquoi l’hydrolyse de l’acide
acétylsalicylique ne peut-elle avoir lieu ?
5. Pourquoi recommande-t-on d’utiliser de la verrerie bien sèche
?
6. Écrire la réaction d’hydrolyse de l’anhydre
acétique en excès.
7. Pourquoi n’attend-on pas que le mélange réactionnel
soit refroidi avant d’ajouter de l’eau ?
8. Identifier les espèces chimiques contenues dans le filtrat
à la fin de l’opération de cristallisation.
9. Quelle est la principale impureté éliminée
par filtration ?
