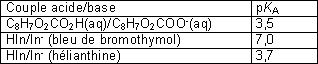1. Questions préliminaires
Données
physico-chimiques
Composition d’un comprimé d’Aspirine du Rhône®
:
– acide acétylsalicylique 500 mg ;
– excipient : amidon de maïs et poudre de cellulose.
Formule de l’acide acétylsalicylique : 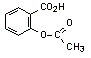
Solubilités à
25 °C

La solution proposée
a été réalisée en dissolvant quatre comprimés
d’aspirine dans un litre d’eau distillée.
Questions
1. Interpréter le trouble observé. Compte tenu des données
précédentes, ce trouble peut-il fausser le titrage ?
2. À l’examen de la formule de l’acide acétylsalicylique,
montrer que l’action d’une solution d’hydroxyde
de sodium peut se modéliser par deux réactions chimiques.
Écrire les équations de ces deux réactions compétitives.
3. Afin de réaliser un titrage acido-basique, il est nécessaire
d’empêcher qu’une de ces deux réactions ait
lieu. Laquelle ? Et comment ?
4. Proposer un protocole opératoire, fondé sur le contrôle
des facteurs cinétiques, pour réaliser ce titrage pH-métrique.
5. Comment le résultat du titrage permet-il de valider le protocole
?
6. Quelle autre méthode de suivi du titrage plus rapide que
le titrage pH-métrique peut-on envisager ?
2. Manipulation :
Le titrage à
froid, par une solution de soude assez diluée, est-il faussé
par la réaction de saponification de la fonction ester ?
– Proposer un mode
opératoire pour le titrage pH-métrique de 50,0 mL de
solution d’Aspirine du Rhône® par une solution d’hydroxyde
de sodium de concentration molaire donnée.
– Tracer la courbe pH = f(V), volume de la solution d’hydroxyde
de sodium versé.
La valeur du volume de
soude versé à l’équivalence permet-elle
de valider ce titrage et au-delà de conclure sur la compétition
cinétique entre la réaction acide-base et la réaction
de saponification ?
3. Manipulation :
Le titrage peut-il
se faire avec un indicateur coloré. Si oui, le virage de celui-ci
indique-t-il bien la fin de la réaction de titrage ?
Questions préliminaires
On considère qu’un indicateur coloré convient
pour un titrage à 1 % près lorsque 99 % de l’acide
à titrer a réagi, alors que seulement 10 % environ de
la forme acide de l’indicateur coloré (début de
sa zone de virage) a réagi avec le réactif titrant.
La mise en œuvre de la compétition entre ces deux réactions
est testée avec deux indicateurs colorés ; l’objectif
étant de choisir celui qui convient pour le titrage.
– Exprimer le rapport 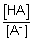 en fonction de la constante d’acidité et de la concentration
molaire en ion oxonium, [H3O+].
en fonction de la constante d’acidité et de la concentration
molaire en ion oxonium, [H3O+].
– En déduire, pour l’acide acétylsalicylique
d’une part et pour les indicateurs colorés à tester
d’autre part, la valeur du rapport 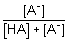 (exprimé en pourcentage), représentant la fraction d’acide
consommé au cours du titrage à ce pH (pH = 6).
(exprimé en pourcentage), représentant la fraction d’acide
consommé au cours du titrage à ce pH (pH = 6).
Conclure quant au choix
de l’indicateur.
Données
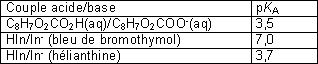
Manipulation
Proposer un protocole opératoire pour le titrage de 50,0 mL
de solution d’Aspirine du Rhône® utilisant un indicateur
coloré.
Mettre en commun les résultats et commenter ces résultats.